Esame neurologico: perchè è importante conoscerlo?
L’esame neurologico è uno strumento clinico utile che permette al fisioterapista di individuare patologie gravi e specifiche. Vediamo come si…
In Italia, il fisioterapista ha la possibilità di lavorare in accesso diretto e ciò comporta che debba possedere tutte le capacità e competenze per discriminare le patologie per cui fare Referral medico o da trattare in concomitanza di un percorso medico appropriato. L’esame neurologico, chiamato anche esame obiettivo (EO) neurologico è uno strumento clinico utile che permette al fisioterapista di individuare patologie gravi e specifiche (direttamente imputabili al danno di una struttura) del tessuto neurale centrale o periferico.
Quando dobbiamo fare l’esame neurologico?
La valutazione neurologica è necessaria ogniqualvolta vi sia il sospetto di una patologia che coinvolge il tessuto neurale, permettendoci di individuare e differenziare patologie del sistema nervoso centrale (SNC) e periferico (SNP).
Ma quali sono le caratteristiche del sintomo che ci spingono a sottoporre il paziente ad un esame neurologico?
Come in un puzzle, non basta un solo tassello per aver un’immagine chiara della presentazione clinica del paziente. Dobbiamo raccogliere i dati necessari a delineare la patologia sia grazie all’anamnesi che all’esame obiettivo (quando necessario e non controindicato). L’anamnesi funge da primo elemento di screening per le patologie gravi che interessano il sistema nervoso poiché ci permette di indagare la presenza delle Red Flag (come p.e. atassia, dizziness, cefalea, nausea, nistagmo, diplopia, disartria, disfagia, incontinenza, alterazione dello stato mentale, etc). Qualora vi siano indizi che alimentano il sospetto di patologia seria, il fisioterapista ha due opzioni in base alla gravità del quadro: compiere un referral immediato o utilizzare dei test neurologici specifici per confermare e avvalorare la sua ipotesi (di cui parleremo nel capitolo successivo).
In assenza di queste Red Flag, sarà la descrizione di un sintomo con caratteristiche neuropatiche a far considerare al fisioterapista la necessità di svolgere un esame neurologico completo. Il dolore neuropatico è definito dalla IASP come “dolore causato da lesione o patologia del sistema nervoso somatosensoriale” (1) e spesso associato a deficit di conduzione del nervo (2).
Ma come facciamo a capire che si tratta di una neuropatia? Abbiamo un primo indizio quando il racconto del paziente suggerisce un dolore derivato da patologia o lesione neurologica piuttosto che da altri tessuti. Il dolore viene descritto come scossa, bruciore, pungente, facilmente evocabile anche da stimoli innocui e talvolta accompagnato da parestesie. In letteratura sono riportati dei questionari validati che possono aiutare il fisioterapista ad identificare il dolore neuropatico, come il Neuropathic Pain Symptom Inventory (3) e il Neuropathic Pain Scale (4). La storia dell’insorgenza del sintomo deve far pensare a un coinvolgimento diretto neurale e la sua comparsa deve esser in correlazione temporale variabile con l’evento scatenante, con manifestazione immediata o dilazionata di settimane. La distribuzione del sintomo deve esser “neuro-anatomicamente plausibile”, cioè anatomicamente consistente con la lesione sospettata a livello del SNC o SNP. Questo significa che, nel caso sospettiamo una radicolopatia ci aspettiamo una distribuzione dermatomerica del sintomo, mentre nel caso di una neuropatia da intrappolamento, un dolore che rispecchia l’innervazione di quel nervo. Ma la definizione di “neuro-anatomicamente plausibile” ha poco valore perché è difficilmente determinabile. Infatti, i sintomi extra-dermatomerici e extraterritoriali sono comuni (5,6,7), a causa dell’overlap dermatomerico e dei sintomi derivanti da strutture profonde (come sclerotomi e miotomi). Inoltre, la neuro-infiammazione causata dal danno neurale è in grado di diffondersi anche in strutture lontane dal sito della lesione (8), interessando il ganglio dorsale della radice, il corno dorsale del midollo spinale (9) e i centri superiori del dolore (10).
Quando le prime caratteristiche di cui abbiamo parlato sono soddisfatte, è “possibile” che ci si trovi dinanzi a un dolore neuropatico (2). A questo punto è necessario eseguire l’esame neurologico per supportare l’ipotesi diagnostica.
Test clinici neurologici
In un sospetto di patologia del SNC, l’utilizzo dei test neurologici aiuta il fisioterapista a confermare il quadro clinico e ad effettuare referral medico. Oltre all’esame neurologico standard, che approfondiremo più avanti, vi sono numerosi test specifici che possono aiutare il clinico ad individuare le disfunzioni del motoneurone superiore (come nel caso di mielopatia, stroke, etc) e altre patologie che coinvolgono il tessuto neurale centrale (come disordini arteriosi cervicali, sclerosi multipla, etc…). I test clinici neurologici più comuni sono:
- Hoffmann Sign (11,12,13,14,15);
- Lhermitthe Sign (12,16,17);
- Segno di Babinski (13,14);
- Inverted supinator sign (13);
- Clonus test (13,14,18);
- Riflessi osteotendinei (Iperreflessia) (12, 13);
- Romberg test (13);
- Esame dei nervi cranici (19);
- Analisi della marcia (20, 21).
Questi test, presi singolarmente, hanno valori di accuratezza bassi ma, quando vengono utilizzati in cluster e integrati alle informazioni anamnestiche il loro valore predittivo nel riconoscere situazioni non di nostra competenza aumenta.
Quando siamo dinanzi a patologie del SNP, come per esempio radicolopatie e neuropatie da intrappolamento, l’esame neurologico permette al fisioterapista di valutare la condizione di baseline del paziente e decidere, in base alla gravità, se è opportuno trattarle o compiere un referral medico. Inoltre, è uno strumento indispensabile nelle successive sedute per monitorare l’andamento del quadro clinico e di conseguenza adeguare il percorso terapeutico.
Come si fa l’esame neurologico?
I cambiamenti patofisiologici all’interno del nervo causano due tipi di alterazione della funzione neurale che prendono il nome di Loss of Function e Gain of Function.
L’esame neurologico indaga il dominio della Loss of Function. Sfortunatamente, utilizzando il classico esame neurologico standard (valutazione della sensibilità tattile fine, riflessi e forza muscolare) rischiamo di perdere informazioni cliniche essenziali. L’esame neurologico standard esamina unicamente la funzionalità delle fibre grandi mieliche (p.e. Aβ e fibre motorie) che compongono solo il 20% del nervo periferico, incrementando il rischio di ottenere dei falsi negativi causati dalla bassa sensibilità di questi test.
A livello patofisiologico, sappiamo che lesioni severe e acute causano prevalentemente una degenerazione delle fibre grandi mieliche situate in loco e a valle del danno (degenerazione walleriana), mentre la conduzione delle fibre amieliniche è resistente alle compressioni acute (22). Invece, una compressione lenta e progressiva causa un’alterazione predominante delle fibre amieliche (8), provocando una ridotta densità di innervazione rilevabile nella biopsia cutanea, mentre le grandi fibre mieliche rimangono intatte e mostrano segni di alterazione mielinica come l’ampliamento della distanza tra i Nodi di Ranvier. La disfunzione delle piccole fibre spesso precede i cambiamenti delle grandi fibre (23).
L’esame della sensibilità deve quindi valutare sia le piccole che le grandi fibre. Per nostra fortuna, in questo dominio dell’Esame Neurologico i deficit rilevabili tra neuropatie prossimali (radicolopatie) e periferiche (neuropatie da entrapment) sono paragonabili (24).
La funzione delle piccole fibre (Aδ e C) può esser testata valutando la sensibilità dolorifica e termica. Esaminiamo la soglia dolorifica del paziente attraverso il NeuroTip, applicando una pressione sufficiente a produrre pallore nella pelle e senza penetrazione (Pin Prick). Il test è positivo quando la percezione è ridotta rispetto una regione diversa nello stesso arto o rispetto all’arto controlaterale. Ricordiamoci di esplorare tutta la superficie dell’arto e non solo il dermatomero sospetto perché spesso i sintomi sono extra-dermatomerici. La corrispondenza del deficit rilevato con un dermatomero è solo un elemento che rafforza la nostra ipotesi, ma su cui non dobbiamo basare la nostra valutazione. Per risparmiare tempo, è consigliabile usare di usare la Neuro Tip Wheel, che permette di analizzare più velocemente ampie aree del corpo rispetto al NeuroTip. Ogni volta che si individua una regione con ridotta soglia dolorifica, è bene esplorarla con il NeuroTip, essendo lo strumento più validato. Il Pin Prick con NeuroTip ha un’accuratezza del 88% per individuare una degenerazione delle piccole fibre. Quando negativo, è necessario indagare anche la soglia termica (caldo-freddo) per escludere il coinvolgimento delle piccole fibre. È possibile utilizzare una moneta a temperatura ambiente per testare la soglia termica del freddo e tenere una moneta nella tasca per almeno 30 minuti per la soglia del caldo. Il test è positivo se il paziente percepisce in modo ridotto la temperatura della stessa moneta (“meno fredda” o “meno calda” rispettivamente) quando viene posizionata in zone diverse nello stesso arto o dell’arto controlaterale. Se sia la soglia del caldo che del freddo non sono alterate, c’è un 98% di possibilità che le fibre di piccolo calibro non siano coinvolte (25).
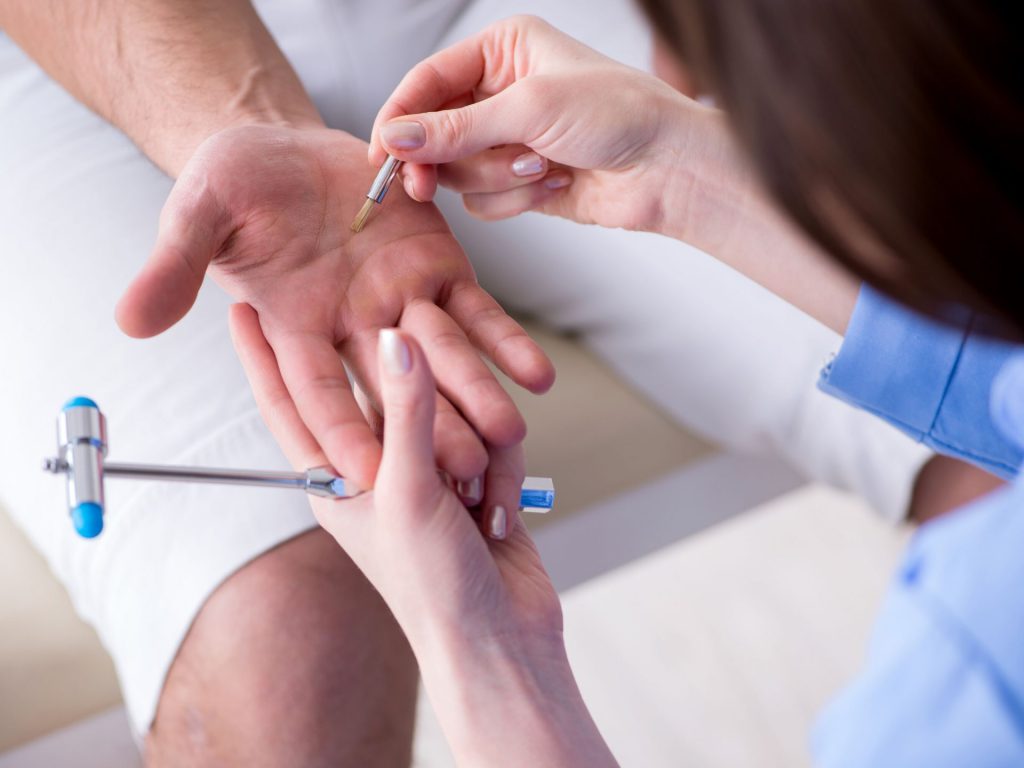
Passiamo ora ad analizzare le fibre sensoriali di grosso calibro (Aβ). Valutiamo la sensibilità tattile fine utilizzando un batuffolo di cotone o il pennellino. Anche in questo caso dobbiamo indagare tutta la superficie in modo circolare, per poi compararla al controlaterale o con un’altra area di riferimento nello stesso arto per individuare un’alterazione.
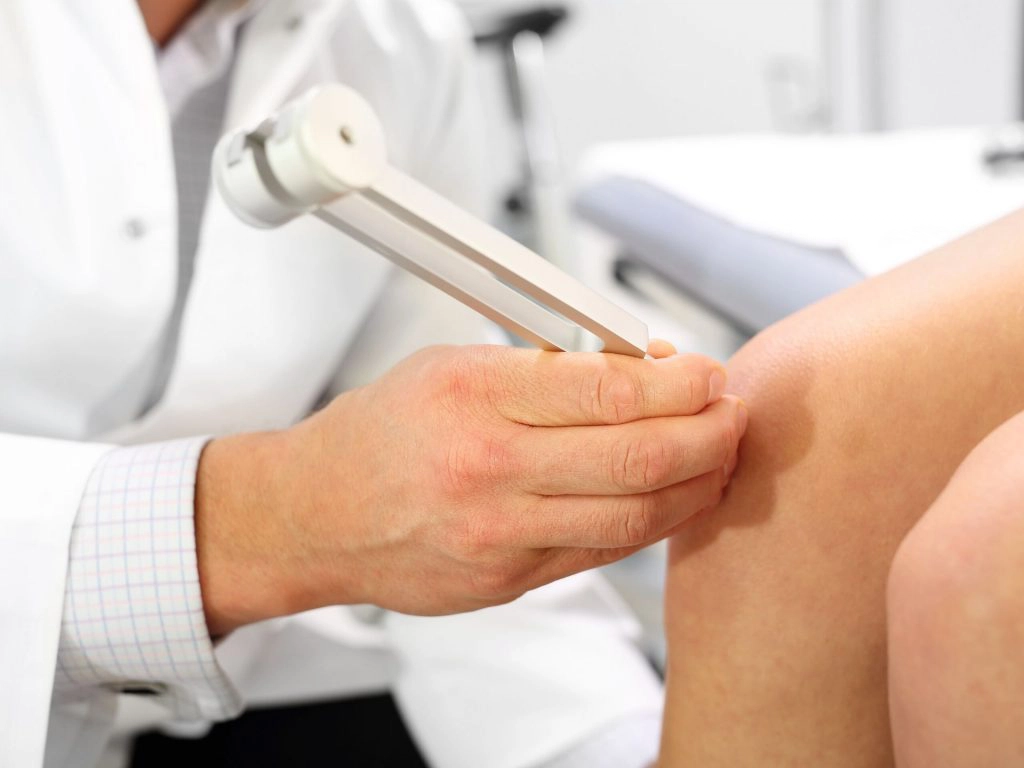
Successivamente, testiamo la sensibilità vibratoria appoggiando un diapason vibrante sulle prominenze ossee salienti come olecrano, stiloide radiale, rotula, malleolo peroneale, etc. (26, 27) e chiediamo al paziente di dirci il momento esatto in cui si arresta la vibrazione. Il test viene eseguito sull’arto da esaminare e risulterà positivo se il paziente avvertirà una sensazione alterata in termini di quantità, qualità e durata rispetto al controlaterale.
Un altro aspetto fondamentale dell’esame neurologico è la valutazione dei riflessi osteo-tendinei, ossia il riflesso miotatico. Si testa colpendo, normalmente con il martelletto, il tendine bersaglio per generare un piccolo e rapido allungamento del muscolo. Questo attiva i recettori all’interno del fuso muscolare del neurone afferente, il cui corpo è nel ganglio dorsale. Il segnale afferente giunge attraverso le fibre Ia al midollo spinale, dove compie sinapsi con l’alfa-motoneurone, che attivandosi comporta la contrazione del muscolo. A livello spinale, alcune fibre Ia del neurone afferente deviano e attivano anche un interneurone inibitorio che impedisce la contrazione del muscolo antagonista durante l’attivazione del riflesso. La corteccia cerebrale e il tronco encefalico influenzano l’input sensoriale dei fusi muscolari modulando l’attività dei gamma-motoneuroni localizzati nel corno anteriore del midollo. Questa modulazione discendente cortico-spinale ha un effetto prevalentemente inibitorio (28). L’esame dei riflessi neurologici testa quindi componenti del sistema nervoso periferico, centrale e muscolo-scheletriche (29).

Le patologie a carico delle diverse componenti creeranno alterazioni differenti dei riflessi, classificate in base all’ampiezza della risposta in una scala da 0 a 4:
- 0 = nessuna risposta, sempre anormale;
- 1 = risposta lieve ma presente, potrebbe esser normale o anormale;
- 2 = risposta vivace, normale;
- 3 = risposta molto vivace; potrebbe esser normale o anormale;
- 4 = clono, sempre anormale.
I riflessi più comunemente testati sono 6: bicipitale, tricipitale, brachioradiale, patellare, achilleo e il jaw jerk. Come sempre, dobbiamo paragonare il risultato con l’arto controlaterale. A livello pratico, è consigliato usare il martelletto Babinky o Queen Square (tondi) perché sono più efficaci del martelletto Taylor (quadrangolare) nell’evocare riflessi ipo-elicitabili. (30)
L’ultimo step dell’esame neurologico è il test neurologico della forza muscolare. Questa valutazione permette di individuare le patologie dove il deficit di forza è prominente e il risultato del test orienta il clinico riguardo il possibile sito o livello della lesione neurale. La muscolatura può essere testata in una posizione che permetta di annullare la gravità qualora si preveda un deficit di forza importante. In questi casi, dobbiamo osservare e palpare la muscolatura durante il test, in modo da percepire una eventuale contrazione, qualora il muscolo non sia in grado di produrre il movimento. Quando il deficit di forza è minore, valutiamo il muscolo in posizione antigravitaria e aggiungiamo una resistenza manuale progressiva. Paragoniamo sempre entrambi gli arti per individuare eventuali differenze di forza. Il metodo più accettato di valutazione della forza muscolare è il Medical Research Council Manual Muscle Testing scale, che assegna un valore da 0 a 5, ossia:
- 0 Nessuna attivazione muscolare
- 1 Attivazione muscolare, senza raggiungere l’intero Range of Motion (ROM)
- 2 Movimento con gravità eliminata, per l’intero ROM
- 3 Movimento contro gravità, per l’intero ROM
- 4 Movimento contro resistenza non-massimale, per l’intero ROM
- 5 Movimento contro massima resistenza, per l’intero ROM
Per quantificare la forza del paziente, è possibile utilizzare anche un dinamometro manuale, tuttavia l’alto costo potrebbe rappresentare un limite alla comune pratica clinica, e affidabilità e validità della misurazione sono fortemente influenzate dalla forza del professionista che lo utilizza (31).
L’esame neurologico permette di monitorare il paziente durante il percorso riabilitativo ed è consigliato eseguirlo ad ogni seduta qualora sia presente un deficit di conduzione neurale. Rappresenta un’ottima misura di outcome inter-seduta. Nel caso ci trovassimo dinanzi a un deficit grave (paralisi o paresi, anestesia estesa, etc.) o peggioramento ingravescente dei segni neurologici occorre compiere un Referral medico.
Conclusione
L’esame neurologico obiettivo completo è uno strumento clinico fondamentale per il fisioterapista. Rappresenta infatti una valutazione sicura e a basso costo, al fine di aumentare il valore predittivo delle ipotesi del clinico. Da ultimo, può essere eseguito rapidamente e non richiede un equipaggiamento specialistico e costoso.
-
- IASP. Global year against neuropathic pain. 2015; Available at: http://www.iasp-pain.org/GlobalYear/NeuropathicPain?navItemNumber5580.
- Finnerup, N. B., Haroutounian, S., Kamerman, P., Baron, R., Bennett, D. L. H., Bouhassira, D., Cruccu, G., Freeman, R., Hansson, P., Nurmikko, T., Raja, S. N., Rice, A. S. C., Serra, J., Smith, B. H., Treede, R.-D., & Jensen, T. S. (2016). Neuropathic pain: An updated grading system for research and clinical practice. PAIN, 157(8), 1599–1606. https://doi.org/10.1097/j.pain.0000000000000492
- Padua, L., Briani, C., Jann, S., Nobile-Orazio, E., Pazzaglia, C., Morini, A., Mondelli, M., Ciaramitaro, P., Cavaletti, G., Cocito, D., Fazio, R., Santoro, L., Galeotti, F., Carpo, M., Plasmati, R., Benedetti, L., Schenone, A., Marchettini, P., & Cruccu, G. (2009). Validation of the Italian version of the Neuropathic Pain Symptom Inventory in peripheral nervous system diseases. Neurological Sciences, 30(2), 99–106. https://doi.org/10.1007/s10072-009-0025-y
- Negri, E., Bettaglio, R., Demartini, L., Allegri, M., Barbieri, M., Miotti, D., Paulin, L., Buonocore, M., & Bonezzi, C. (2002). Validazione della «Scala del Dolore Neuropatico» (SDN) e sue applicazioni terapeutiche. MINERVA ANESTESIOLOGICA, 68(3), 10.
- Nora, D. B., Becker, J., Ehlers, J. A., & Gomes, I. (2004). Clinical features of 1039 patients with neurophysiological diagnosis of carpal tunnel syndrome. Clinical neurology and neurosurgery, 107(1), 64–69. https://doi.org/10.1016/j.clineuro.2004.08.003
- Zanette, G., Cacciatori, C., & Tamburin, S. (2010). Central sensitization in carpal tunnel syndrome with extraterritorial spread of sensory symptoms. Pain, 148(2), 227–236. https://doi.org/10.1016/j.pain.2009.10.025
- Murphy, D. R., Hurwitz, E. L., Gerrard, J. K., & Clary, R. (2009). Pain patterns and descriptions in patients with radicular pain: Does the pain necessarily follow a specific dermatome? Chiropractic & Osteopathy, 17(1), 9. https://doi.org/10.1186/1746-1340-17-9
- Schmid, A. B., Coppieters, M. W., Ruitenberg, M. J., & McLachlan, E. M. (2013). Local and remote immune-mediated inflammation after mild peripheral nerve compression in rats. Journal of neuropathology and experimental neurology, 72(7), 662–680. https://doi.org/10.1097/NEN.0b013e318298de5b
- Hu, P., Bembrick, A. L., Keay, K. A., & McLachlan, E. M. (2007). Immune cell involvement in dorsal root ganglia and spinal cord after chronic constriction or transection of the rat sciatic nerve. Brain, behavior, and immunity, 21(5), 599–616. https://doi.org/10.1016/j.bbi.2006.10.013
- Mor, D., Bembrick, A. L., Austin, P. J., Wyllie, P. M., Creber, N. J., Denyer, G. S., & Keay, K. A. (2010). Anatomically specific patterns of glial activation in the periaqueductal gray of the sub-population of rats showing pain and disability following chronic constriction injury of the sciatic nerve. Neuroscience, 166(4), 1167–1184. https://doi.org/10.1016/j.neuroscience.2010.01.045
- Grijalva, R. A., Hsu, F. P. K., Wycliffe, N. D., Tsao, B. E., Williams, P., Akpolat, Y. T., & Cheng, W. K. (2015). Hoffmann Sign: Clinical Correlation of Neurological Imaging Findings in the Cervical Spine and Brain. Spine, 40(7), 475–479. https://doi.org/10.1097/BRS.0000000000000794
- Cook, C. E., Hegedus, E., Pietrobon, R., & Goode, A. (2007). A Pragmatic Neurological Screen for Patients With Suspected Cord Compressive Myelopathy. Physical Therapy, 87(9), 1233–1242. https://doi.org/10.2522/ptj.20060150
- Cook, C., Roman, M., Stewart, K. M., Leithe, L. G., & Isaacs, R. (2009). Reliability and Diagnostic Accuracy of Clinical Special Tests for Myelopathy in Patients Seen for Cervical Dysfunction. Journal of Orthopaedic & Sports Physical Therapy, 39(3), 172–178. https://doi.org/10.2519/jospt.2009.2938
- Houten, J. K., & Noce, L. A. (2008). Clinical correlations of cervical myelopathy and the Hoffmann sign. Journal of neurosurgery. Spine, 9(3), 237–242. https://doi.org/10.3171/SPI/2008/9/9/237
- Glaser, J. A., Curé, J. K., Bailey, K. L., & Morrow, D. L. (2001). Cervical spinal cord compression and the Hoffmann sign. The Iowa orthopaedic journal, 21, 49–52.
- Beckmann, Y., Özakbaş, S., Bülbül, N. G., Kösehasanoğulları, G., Seçil, Y., Bulut, O., İncesu, T. K., Tokuçoğlu, F., & Ertekin, C. (2015). Reassessment of Lhermitte’s sign in multiple sclerosis. Acta Neurologica Belgica, 115(4), 605–608. https://doi.org/10.1007/s13760-015-0466-4
- Gemici C. (2010). Lhermitte’s sign: Review with special emphasis in oncology practice. Critical reviews in oncology/hematology, 74(2), 79–86. https://doi.org/10.1016/j.critrevonc.2009.04.009
- Young W. F. (2000). Cervical spondylotic myelopathy: a common cause of spinal cord dysfunction in older persons. American family physician, 62(5), 1064–1073.
- Damodaran, O., Rizk, E., Rodriguez, J., & Lee, G. (2014). Cranial nerve assessment: a concise guide to clinical examination. Clinical anatomy (New York, N.Y.), 27(1), 25–30. https://doi.org/10.1002/ca.22336
- Baker, R., Esquenazi, A., Benedetti, M. G., & Desloovere, K. (2016). Gait analysis: Clinical facts. European Journal of Physical and Rehabilitation Medicine, 52(4), 15.
- Jahn, K., Zwergal, A., & Schniepp, R. (2010). Gait disturbances in old age: classification, diagnosis, and treatment from a neurological perspective. Deutsches Arzteblatt international, 107(17), 306–316. https://doi.org/10.3238/arztebl.2010.0306
- Basbaum, A. I., Gautron, M., Jazat, F., Mayes, M., & Guilbaud, G. (1991). The spectrum of fiber loss in a model of neuropathic pain in the rat: An electron microscopic study: Pain, 47(3), 359–367. https://doi.org/10.1016/0304-3959(91)90229-Q
- Schmid, A. B., Bland, J. D. P., Bhat, M. A., & Bennett, D. L. H. (2014). The relationship of nerve fibre pathology to sensory function in entrapment neuropathy. Brain, 137(12), 3186–3199. https://doi.org/10.1093/brain/awu288
- Tampin, B., Vollert, J., & Schmid, A. B. (2018). Sensory profiles are comparable in patients with distal and proximal entrapment neuropathies, while the pain experience differs. Current Medical Research and Opinion, 34(11), 1899–1906. https://doi.org/10.1080/03007995.2018.1451313
- Ridehalgh, C., Sandy-Hindmarch, O. P., & Schmid, A. B. (2018). Validity of Clinical Small–Fiber Sensory Testing to Detect Small–Nerve Fiber Degeneration. Journal of Orthopaedic & Sports Physical Therapy, 48(10), 767–774. https://doi.org/10.2519/jospt.2018.8230
- Gilman, S. (2002). Joint position sense and vibration sense: Anatomical organisation and assessment. Journal of Neurology, Neurosurgery & Psychiatry, 73(5), 473–477. https://doi.org/10.1136/jnnp.73.5.473
- Reggars J. W. (1995). VIBRATORY SENSATION TESTING: Practice Tip. COMSIG review, 4(1), 14–15.
- Walker HK. Deep Tendon Reflexes. In: Walker HK, Hall WD, Hurst JW, editors. Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd edition. Boston: Butterworths; 1990. Chapter 72. Available from: https://www.ncbi.nlm.nih.gov/books/NBK396/
- Zimmerman B, Hubbard JB. Anatomy, Deep Tendon Reflexes (Stretch Reflexes) [Updated 2020 May 6]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK531502/
- Marshall, G. L., & Little, J. W. (2002). Deep Tendon Reflexes: A Study Of Quantitative Methods. The Journal of Spinal Cord Medicine, 25(2), 94–99. https://doi.org/10.1080/10790268.2002.11753608
- Bohannon, R. W. (2019). Considerations and Practical Options for Measuring Muscle Strength: A Narrative Review. BioMed Research International, 2019, 1–10. https://doi.org/10.1155/2019/8194537.


