Artrosi di ginocchio
Una guida per il fisioterapista su valutazione e trattamento del paziente con artrosi di ginocchio.
L’osteoartrosi è la forma più comune di artrite, nonché la patologia muscolo-scheletrica progressiva più frequente nella popolazione anziana. I distretti più colpiti in assoluto sono anca, ginocchio e mano1. Dopo le malattie cardiovascolari, tra le condizioni muscolo-scheletriche è seconda solo al low back pain come causa prevalente di disabilità e riduzione dell’attività lavorativa2, oltre ad essere associata a un’importante riduzione della qualità della vita3.
Facendo riferimento all’osteoartrosi di ginocchio, la sua prevalenza tra gli adulti di età pari o superiore a 60 anni è stimata intorno al 10% negli uomini e il 13% nelle donne2, ma va evidenziato quanto questi dati siano cresciuti nel corso degli ultimi decenni a causa del progressivo aumento dell’aspettativa di vita e dell’esposizione a tutti i fattori di rischio che ne favoriscono insorgenza e sviluppo3.
Contrariamente a quanto si riteneva anni fa, oggi sappiamo che l’osteoartrosi non è solamente una patologia caratterizzata da perdita di cartilagine articolare causata dal carico meccanico, ma una condizione che colpisce l’articolazione in toto, provocando cambiamenti nella struttura, nel metabolismo e nella funzione di tutti i tessuti2.
Allo stato dell’arte va riportata la classificazione di Kellgren-Lawrence di 5 gradi basata su parametri puramente radiografici: essa va da 0, ovvero un ginocchio radiograficamente perfetto, a 4, dove lo spazio articolare sarà drasticamente ridotto e la cartilagine quasi completamente scomparsa. Nonostante sia giusto tenere a mente tale classificazione, sappiamo quanto severità clinica e indagini strumentali spesso siano scarsamente correlate; per questo sarà fondamentale andare a valutare nei pazienti tutti le componenti biologiche senza però tralasciare gli aspetti psicosociali.
Tipologia di paziente
I fattori di rischio per lo sviluppo di osteoartrosi si dividono in non modificabili e modificabili: tra i primi troviamo sesso, quello femminile più colpito, età maggiore di 50 anni, traumi pregressi o infortuni (lesioni meniscali o del crociato anteriore principalmente, e sindrome femoro-rotulea) e fattori anatomici di mal-allineamento come varismo o valgismo che però, contrariamente a quanto si potrebbe pensare, non sono necessariamente sinonimo di osteoartrosi futura, ma lo diventano se progressivi nel tempo2. La componente genetica riveste un ruolo meno importante nel ginocchio rispetto ad altri distretti (mano e anca), tuttavia vi è una prevalenza etnica e geografica della patologia nella razza caucasica rispetto a quella africana e asiatica2.
Tra i fattori di rischio modificabili invece vanno elencati obesità, fattori occupazionali (inginocchiarsi o sollevare pesi importanti) e sedentarietà2. Per quanto riguarda l’attività fisica è stato evidenziato come uno stile di vita sedentario o un’esposizione massiva in termini di volume e intensità alla corsa siano associati ad osteoartrosi di anca e ginocchio: fare esercizio fisico non rappresenta dunque un fattore di rischio di sviluppare la patologia, se eseguito con carico moderato4.
Patofisiologia
Sappiamo come tutti i componenti della cartilagine articolare siano sintetizzati dai condrociti, che svolgono un ruolo chiave nel mantenimento dell’omeostasi interna fornendo un turnover equilibrato tra processi anabolici e catabolici2. Il metabolismo cartilagineo è stimolato dal carico meccanico attraverso meccanocettori che, mediante un processo di meccanotrasduzione, modulano l’attività biochimica dei condrociti, inducendo la biosintesi delle molecole per preservare l’integrità del tessuto2.
L’importanza di un corretto carico meccanico è dimostrata dal fatto che stimoli biomeccanici insufficienti, come l’immobilizzazione, possano portare a una riduzione dello spessore (>10%) della cartilagine articolare nell’articolazione del ginocchio2. Al contrario, un carico meccanico eccessivo potrebbe portare ad uno squilibrio quantitativo tra attività anabolica e catabolica con conseguente esaurimento dei componenti della matrice e, a causa della mancanza di capacità rigenerativa cartilaginea, a un danno irreversibile, dando inizio ad un processo osteoartrosico.
Come detto inizialmente, vanno considerate tutte le componenti dell’articolazione nell’analisi e spiegazione del quadro clinico del soggetto con tale patologia: è ormai consolidato il fatto che alterazioni ossee subcondrali e infiammazione della membrana sinoviale (molto innervati a differenza della cartilagine articolare) siano importanti caratteristiche della malattia. Numerosi studi suggeriscono come le interazioni tra cartilagine e osso subcondrale siano fondamentali per l’omeostasi articolare, ma anche nella progressione della malatti2: a un assottigliamento e fissurazione della cartilagine articolare si associano modificazioni dell’osso trabecolare subcondrale in termini di deterioramento nello stadio iniziale e sclerosi nella fase avanzata2.
Tra le cause patofisiologiche del disturbo va sicuramente citata una riduzione della funzione shock absorber meniscale che conduce a perdita di lubrificazione, instabilità articolare e picchi di pressione meccanici intraarticolari2. Nei pazienti con osteoartrosi confermata radiograficamente, un danno o sofferenza del menisco è quasi sempre presente, tuttavia è necessario tenere a mente come la gestione della problematica dovrebbe essere incentrata sul miglioramento dei sintomi e delle limitazioni funzionali e non guidata dai risultati dell’imaging: l’alto tasso di anziani asintomatici di età ≥40 anni con segni di osteoartrosi del ginocchio alla risonanza magnetica aiuta a spiegare questo aspetto poiché spesso gli esami strumentali possono riflettere i normali processi di invecchiamento5.
Diagnosi differenziale
Diamo un’occhiata ora alle patologie da escludere durante il processo di diagnosi differenziale e a quelle invece a cui bisogna prestare attenzione, poiché simili nell’esordio all’artrosi ma ben più gravi. Tra le condizioni da escludere quando si valuta un paziente con sospetta artrosi di ginocchio (che potete approfondire tramite appositi link) abbiamo:
Tra le patologie che richiedono invece un referral medico vi sono:
- artrite reumatoide;
- artrite psoriasica;
- artrite da cristalli;
- artrite settica;
- radicolopatia L3/L4.
Elementi anamnestici
Il paziente con osteoartrosi, almeno nella fase iniziale, avrà un dolore regionale prevalentemente nocicettivo e correlato al carico, che peggiora durante o dopo l’attività e migliora con il riposo (la sintomatologia notturna potrebbe essere presente nelle fasi più avanzate). Tra i sintomi caratteristici vi sono dolorabilità diffusa (i distretti più colpiti sono femoro-tibiale mediale e femoro-rotuleo), lieve gonfiore, sensazione di instabilità del ginocchio e rigidità mattutina della durata massima di 30 minuti.
Esame obiettivo e valutazione
Durante la valutazione del paziente con artrosi di ginocchio, i segni più comuni sono i seguenti:
- limitazione del Range of Motion;
- deficit di forza dell’arto inferiore (quadricipite femorale, glutei);
- riduzione della funzionalità nelle attività di vita quotidiana (ADL);
- crepitio;
- ingrossamento/deformità ossea;
- infiammazione articolare lieve o modesta;
- punteggi scarsi alle scale LEFS, WOMAC e SF-36.
Data la cronicità della patologia, in una fase più avanzata potrebbero sopraggiungere anche alterazioni dei meccanismi del dolore con una componente importante di dolore nociplastico: avremo perciò un paziente sensibilizzato, positivo ai clinical sensory testing e spesso con aspetti importanti derivanti dalla sfera psicosociale come ansia, depressione, kinesiofobia e scarsa autoefficacia (self-efficacy).
Trattamento
Una gestione ottimale del paziente con osteoartrosi di ginocchio richiede un tipo di approccio multimodale, sviluppato dal fisioterapista in accordo con le preferenze del paziente, in modo da attuare il trattamento più sicuro ed efficace possibile1. Ogni paziente dovrebbe essere valutato tenendo conto dello stato di salute generale (diabete, problematiche cardiache o vascolari) al fine di ridurre al minimo gli effetti collaterali da farmaci e misurare correttamente il trattamento fisioterapico.
All’interno della letteratura scientifica sono disponibili numerose linee guida che forniscono informazioni su come valutare i pazienti e soprattutto su come trattarli.
Le linee guida italiane3 ci indicano come trattamenti con forte evidenza:
- educazione – costruire un programma personalizzato di informazione, far comprendere al paziente gli obiettivi da raggiungere e gli interventi da attuare a breve e lungo termine;
- perdita di peso;
- esercizio terapeutico – non sembra esistere un esercizio migliore di altri, è importante promuovere l’attività fisica generale considerando le preferenze del paziente con esercizi di forza, resistenza, aerobici o in acqua;
- autotrattamento – è fondamentale che venga consegnato al paziente un regolare regime di esercizi individualizzato da eseguire quotidianamente;
- utilizzo di ortesi e ausili – possono prevenire la progressione dei cambiamenti degenerativi e migliorano la funzione;
- trattamento farmacologico – FANS e infiltrazioni di corticosteroidi.

Trattamenti con minor evidenza sono risultati essere:
- terapia manuale;
- bendaggio con tape;
- TENS;
- agopuntura.
Molto simili sono quelle americane1, che descrivono come efficaci gli stessi trattamenti delle linee guida italiane con l’aggiunta del Tai Chi, esercizi di equilibrio e yoga.
In Danimarca è stato creato, con ottimi risultati, un protocollo evidence-based di nome GLAD6 basato su educazione e training neuromuscolare con l’obiettivo generale di implementare le attuali linee guida cliniche per l’osteoartrosi di anca e ginocchio.
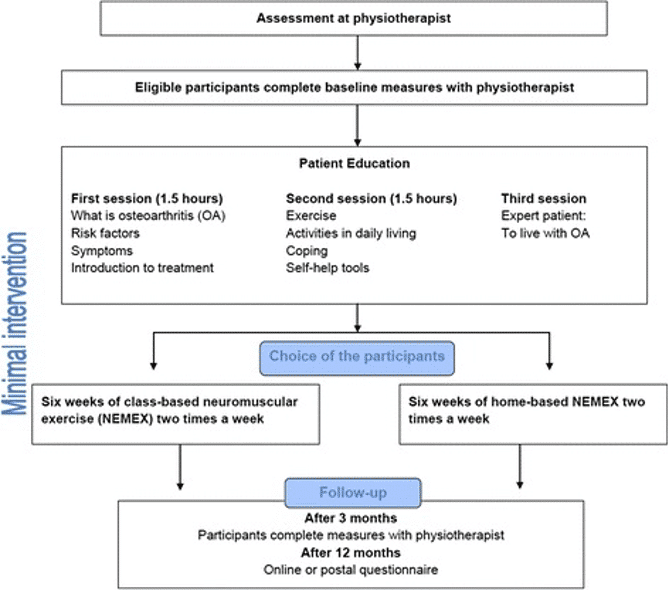
La Figura 16 rappresenta l’organizzazione delle sedute di educazione, di esercizio neuromuscolare e di rivalutazione.
In conclusione, educazione ed esercizio rappresentano attualmente i migliori trattamenti possibili per l’osteoartrosi poiché, oltre a ridurre il dolore e migliorare la funzione, migliorano la self-confidence, l’ansia, la depressione e favoriscono l’alleanza terapeutica.
Prognosi
Dal punto di vista prognostico, sia in ambito clinico che di ricerca, a causa della variabilità di presentazione della patologia è molto difficile fornire tempistiche certe e accurate che possano portare a un miglioramento dei sintomi. Sappiamo che l’osteoartrosi è definita come un continuum, cioè spesso accompagna il soggetto per lunghi periodi a partire dall’età adulta, può avere fasi di riduzione della sintomatologia e poi tornare a limitare il paziente nelle sue attività. Quel che è certo è che, una volta intrapresa la strada conservativa, è necessario creare un percorso riabilitativo diluito nel tempo, ritagliato sul paziente e con sedute di richiamo e di monitoraggio degli esercizi (il protocollo Glad della durata di 6 settimane può essere esteso per periodi più lunghi).
Una revisione sistematica della Cochrane7 ci dice che migliori outcome sono proporzionali al numero di sedute e che l’esercizio supervisionato è migliore di quello non supervisionato; tuttavia, essa dimostra come i benefici del trattamento vengano mantenuti per un tempo relativamente breve, dai 2 ai 6 mesi, dopo la cessazione delle sedute.
All’interno della valutazione dei fattori che possono garantire il successo della terapia conservativa andranno considerati aspetti biologici, impairment fisico e dei tessuti, e aspetti psicosociali; alterazione dei meccanismi del dolore con dolore nociplastico che si aggiunge alla componente nocicettiva, aspetti legati alla sfera psicologica (ansia, depressione, kinesiofobia, coping passivo) e l’esposizione a tutti i fattori di rischio prima citati rappresenteranno degli elementi prognostici negativi.
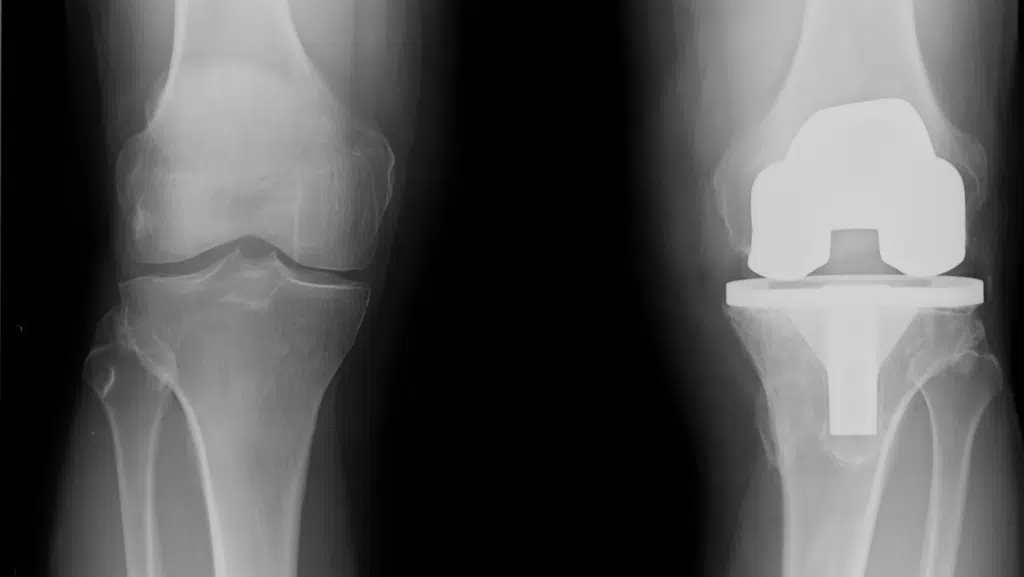
In caso di fallimento della strada conservativa, la chirurgia ortopedica dovrebbe essere presa in considerazione nei pazienti con evidenza radiografica di osteoartrosi, che hanno una marcata disabilità, ridotta qualità della vita e dolore refrattario ad altri trattamenti3.
-
u003colu003ern tu003cliu003eSharon L. Kolasinski, Tuhina Neogi, Marc C. Hochberg, Carol Oatis, Gordon Guyatt, Joel Block, Leigh Callahan, Cindy Copenhaver, Carole Dodge, David Felson, Kathleen Gellar, William F. Harvey, Gillian Hawker, Edward Herzig, C. Kent Kwoh, Amanda E. Nelson, Jonathan Samuels, Carla Scanzello, Daniel White, Barton Wise, Roy D. Altman, Dana DiRenzo, Joann Fontanarosa, Gina Giradi, Mariko Ishimori, Devyani Misra, Amit Aakash Shah, Anna K. Shmagel, Louise M. Thoma, Marat Turgunbaev, Amy S. Turner and James Reston. u003ca href=u0022https://pubmed.ncbi.nlm.nih.gov/31908149/u0022u003eu003cemu003e2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Kneeu003c/emu003eu003c/au003e. Arthritis u0026amp; Rheumatology Vol. 0, No. 0, Month 2020, pp 1–14.u003c/liu003ern tu003cliu003eDragan Primorac, Vilim Molnar, Eduard Rod, Željko Jeleč, Fabijan Čukelj, Vid Matišic´, Trpimir Vrdoljak, Damir Hudetz, Hana Hajsok and Igor Borić. u003ca href=u0022https://pubmed.ncbi.nlm.nih.gov/32722615/u0022u003eu003cemu003eKnee Osteoarthritis: A Review of Pathogenesis and State-Of-The-Art Non-Operative Therapeutic Considerationsu003c/emu003eu003c/au003e. Genes 2020, 11, 854.u003c/liu003ern tu003cliu003eAriani, M. Manara, A. Fioravanti, F. Iannone, F. Salaffi, N. Ughi, I. Prevete, A. Bortoluzzi, S. Parisi, C.A. Scirè. u003cemu003eu003ca href=u0022https://pubmed.ncbi.nlm.nih.gov/31948191/u0022u003eThe Italian Society for Rheumatology clinical practice guidelines for the diagnosis and management of knee, hip and hand osteoarthritisu003c/au003e. u003c/emu003eReumatismo, 2019; 71 (S1): 5-21.u003c/liu003ern tu003cliu003eu003ca href=u0022https://pubmed.ncbi.nlm.nih.gov/28566050/u0022u003eRunning and Osteoarthritis: Does Recreational or Competitive Running Increase the Risk?u003c/au003e. Journal of Orthopaedic u0026amp; Sports Physical Therapy, 2017; 47(6), 391–391.u003c/liu003ern tu003cliu003eAdam G Culvenor, Britt Elin Øiestad, Harvi F Hart, Joshua J Stefanik, Ali Guermazi, Kay M Crossley. u003cemu003eu003ca href=u0022https://pubmed.ncbi.nlm.nih.gov/29886437/#:~:text=Conclusions%3A%20Summary%20estimates%20of%20MRI,considered%20in%20clinical%20decision%2Dmaking.u0022u003ePrevalence of knee osteoarthritis features on magnetic resonance imaging in asymptomatic uninjured adults: a systematic review and meta-analysisu003c/au003e. u003c/emu003eBr J Sports Med 2019;53:1268–1278.u003c/liu003ern tu003cliu003eSøren T. Skou, Ewa M. Roos. u003cemu003eu003ca href=u0022https://pubmed.ncbi.nlm.nih.gov/28173795/u0022u003eGood Life with osteoArthritis in Denmark (GLA:D™): evidence-based education and supervised neuromuscular exercise delivered by certified physiotherapists nationwideu003c/au003e. u003c/emu003eBMC Musculoskeletal Disorders (2017) 18:72.u003c/liu003ern tu003cliu003eMarlene Fransen, Sara McConnell, Alison R Harmer, Martin Van der Esch, Milena Simic, Kim L Bennell. u003cemu003eu003ca href=u0022https://pubmed.ncbi.nlm.nih.gov/26405113/u0022u003eExercise for osteoarthritis of the knee: a Cochrane systematic reviewu003c/au003e. u003c/emu003eBr J Sports Med 2015;49:1554–1557u003c/liu003ernu003c/olu003e
-
- Sharon L. Kolasinski, Tuhina Neogi, Marc C. Hochberg, Carol Oatis, Gordon Guyatt, Joel Block, Leigh Callahan, Cindy Copenhaver, Carole Dodge, David Felson, Kathleen Gellar, William F. Harvey, Gillian Hawker, Edward Herzig, C. Kent Kwoh, Amanda E. Nelson, Jonathan Samuels, Carla Scanzello, Daniel White, Barton Wise, Roy D. Altman, Dana DiRenzo, Joann Fontanarosa, Gina Giradi, Mariko Ishimori, Devyani Misra, Amit Aakash Shah, Anna K. Shmagel, Louise M. Thoma, Marat Turgunbaev, Amy S. Turner and James Reston. 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee. Arthritis & Rheumatology Vol. 0, No. 0, Month 2020, pp 1–14.
- Dragan Primorac, Vilim Molnar, Eduard Rod, Željko Jeleč, Fabijan Čukelj, Vid Matišic´, Trpimir Vrdoljak, Damir Hudetz, Hana Hajsok and Igor Borić. Knee Osteoarthritis: A Review of Pathogenesis and State-Of-The-Art Non-Operative Therapeutic Considerations. Genes 2020, 11, 854.
- Ariani, M. Manara, A. Fioravanti, F. Iannone, F. Salaffi, N. Ughi, I. Prevete, A. Bortoluzzi, S. Parisi, C.A. Scirè. The Italian Society for Rheumatology clinical practice guidelines for the diagnosis and management of knee, hip and hand osteoarthritis. Reumatismo, 2019; 71 (S1): 5-21.
- Running and Osteoarthritis: Does Recreational or Competitive Running Increase the Risk?. Journal of Orthopaedic & Sports Physical Therapy, 2017; 47(6), 391–391.
- Adam G Culvenor, Britt Elin Øiestad, Harvi F Hart, Joshua J Stefanik, Ali Guermazi, Kay M Crossley. Prevalence of knee osteoarthritis features on magnetic resonance imaging in asymptomatic uninjured adults: a systematic review and meta-analysis. Br J Sports Med 2019;53:1268–1278.
- Søren T. Skou, Ewa M. Roos. Good Life with osteoArthritis in Denmark (GLA:D™): evidence-based education and supervised neuromuscular exercise delivered by certified physiotherapists nationwide. BMC Musculoskeletal Disorders (2017) 18:72.
- Marlene Fransen, Sara McConnell, Alison R Harmer, Martin Van der Esch, Milena Simic, Kim L Bennell. Exercise for osteoarthritis of the knee: a Cochrane systematic review. Br J Sports Med 2015;49:1554–1557